【Nature子刊】中国医科院肿瘤医院胰胃外科田艳涛团队携手清华大学蓝勋教授团队通过单细胞RNA测序破译胃癌微环境
2022-09-09 18:05:26
中国医科院肿瘤医院胰胃外科田艳涛教授团队与清华大学蓝勋教授团队合作,应用scRNA-seq绘制了胃癌患者癌、癌旁正常组织和匹配的外周血中免疫、基质和上皮细胞的转录图谱,并结合了T细胞受体(TCR)库谱分析。成果发表于Nature Communications (IF=17.69)。

•在全球范围内,胃癌是一个重大的公共卫生问题,也是第四大与癌症相关死亡原因。在我国,胃癌的发病率在所有癌症中位居第三。2012 - 2015年中国胃癌患者5年生存率为35.1% (34.5%-35.7%),低于同期发达国家水平。肿瘤微环境(tumor microenvironment, TME)对癌症的发生发展具有重要影响,但其特异性尚未被充分认识。
•免疫治疗,特别是针对PD-1和CTLA4的抗体,已经引起了包括黑色素瘤在内的各种癌症治疗模式的转变,但在胃癌的反应率相对较低。既往研究表明,肿瘤间异质性和细胞组成的个体变异与患者预后有关,强调了对肿瘤微环境复杂且多变的生物学特性深入研究的必要性,以期开发出干预的手段。单细胞RNA测序(scRNA-seq)已经成功地用于破译胃癌的肿瘤微环境,以探究和揭示潜在的肿瘤生物学机制。
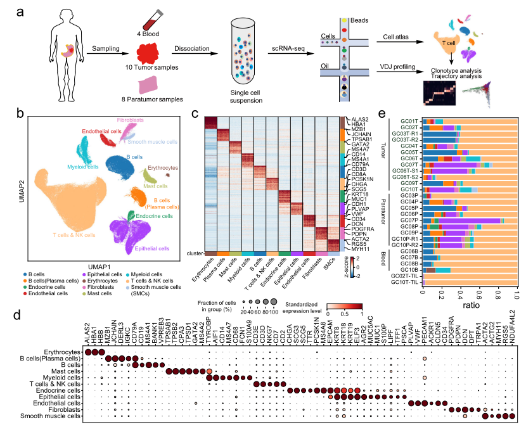
•首先利用scRNA-seq研究胃癌肿瘤微环境,从10名具有匹配的癌和癌旁组织以及血液的胃癌患者中生成了166533个细胞图谱。scRNA-seq图谱被分为12个广泛的免疫细胞、基质细胞和上皮细胞。结合scRNA-seq分析,我们生成了配对的TCR和BCR (T/B细胞受体)测序数据,以研究不同T/B细胞亚型内的状态转换。
A
B
C
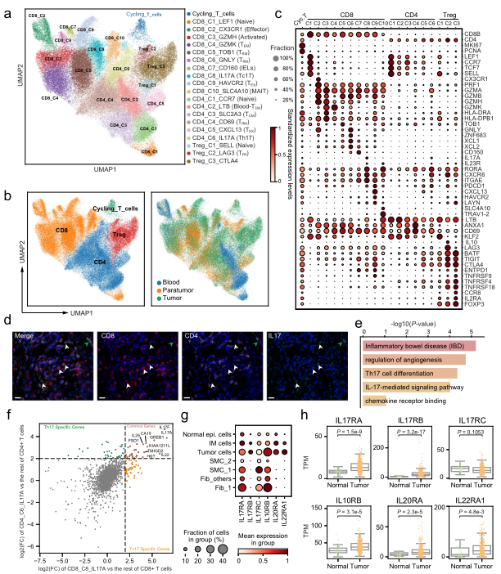
D
A.单细胞水平分析胃癌上皮细胞。B. GC中基质细胞的动态重组。C.髓系细胞分析显示肿瘤组织中脂质相关巨噬细胞的扩张。D.T细胞的分析和聚集揭示了GC生态系统中多种不同的功能状态和基因模块。
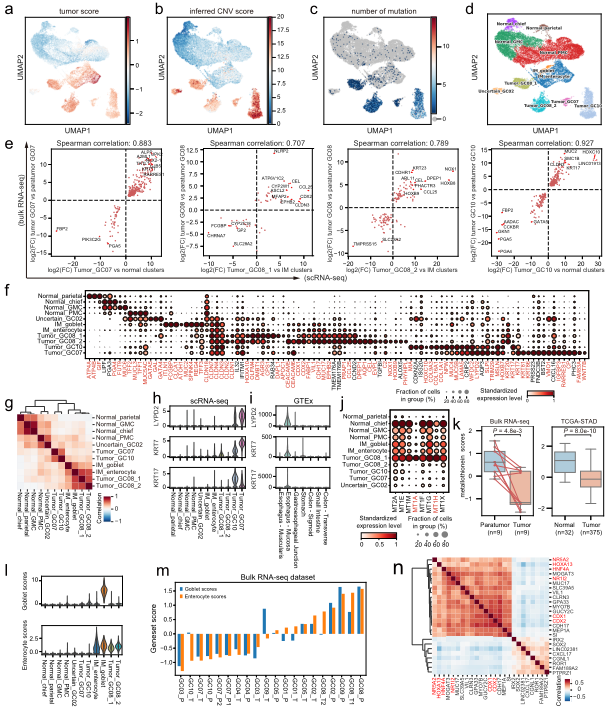
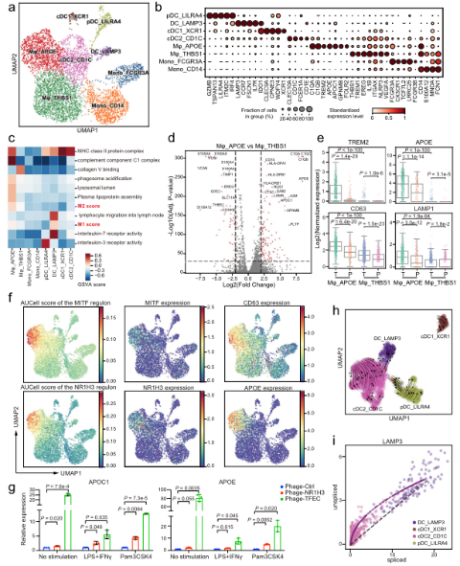
•本研究提供了一个全面的胃癌单细胞转录组图谱,描述了免疫亚群、基质亚群和上皮亚群的详细和复杂的分类,并进一步阐明了它们的分子特征和细胞间通信。*明显的现象是TME中细胞成分的广泛重塑。抑制性Tregs, TASCs, TAMs, Tc17和CD8 +耗尽的T细胞在肿瘤中富集,而肥大细胞,内分泌和滤泡调节性T细胞在肿瘤旁富集。值得注意的是,高比例的TASCs与较差的预后相关。通过配体和受体分析,我们观察到TASCs、Mφ_APOE和LAMP3 + dc作为细胞间相互作用的关键中介因子,共同调控免疫抑制微环境,促进肿瘤进展。阻断这些相互作用,如IL34-CSF1R和TIGIT-NECTIN2轴,可能会被激活TME或启动TME以增加现有免疫治疗GC的疗效。
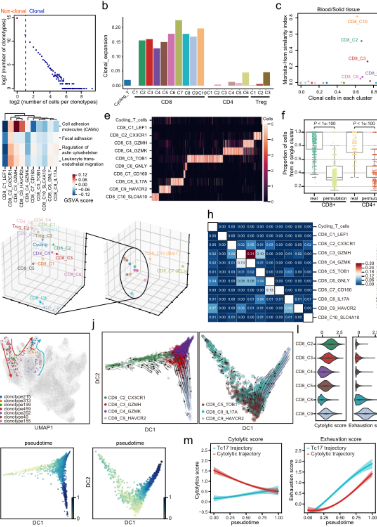
E
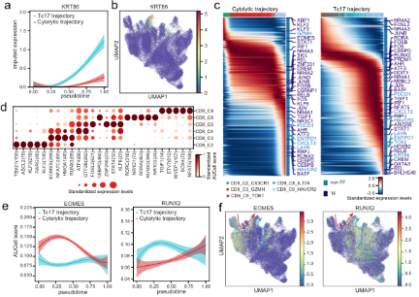
F

G
E.基于TCR共享和轨迹分析的CD8 + T细胞表型转变。F.TF活性沿T细胞衰竭轨迹的动态变化及IL17 + T细胞对胃肿瘤的潜在促进作用。G.细胞间相互作用网络揭示了肿瘤进展的关键途径。
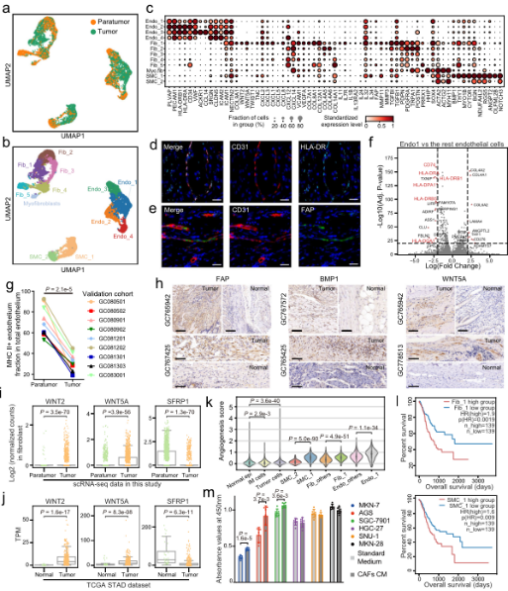
•研究发现肿瘤组织中的基质细胞发生了显著的转变,肿瘤相关基质细胞(TASCs)表现出Wnt信号和血管生成活性上调,并与生存率呈负相关,显示广泛的促肿瘤特征。肿瘤相关的巨噬细胞和LAMP3 + DCs参与介导T细胞活性,并与TASCs形成细胞间相互作用枢纽。细胞间通信分析表明,TASCs、TAMs和LAMP3+DCs是TME中复杂细胞相互作用的关键介质。克隆型和轨迹分析表明,Tc17 (IL-17+ CD8+ T)细胞起源于组织驻留记忆T细胞,随后分化为耗尽的T细胞,为T细胞耗尽提供了另一种途径。我们的结果表明,IL17 +细胞可能通过IL17、IL22和IL26信号通路促进肿瘤进展,这表明靶向IL17 +细胞及其相关信号通路作为治疗GC的治疗策略的可能性。
•研究揭示了胃癌复杂的生物学特性,阐明了细胞亚群与肿瘤进展的关系,并为肿瘤治疗提供了一些有希望的线索。但是本研究也存在一些局限性。纳入研究的患者数量较少,因此我们的分析结果是探索性的,需要在大规模的scRNA-seq队列中进一步验证。其次,scRNA-seq缺乏各种类型细胞的空间分布和染色质可及性等关键信息。
展望:该团队计划利用空间转录组学和scATAC-seq分析由CellPhoneDB推断的这些相互作用的细胞类型的位置关系,并研究TFs在细胞状态重塑中的作用。该团队的研究结果,如TASCs的瘤体特征,应该在患者源性异种移植(PDXs)、患者源性类器官(PDOs)或其他模型系统中进一步验证和推广。此外,还将通过基因工程小鼠模型(GEMMs)等方法进一步研究GC细胞表型重塑的潜在分子机制和调控途径。